目次
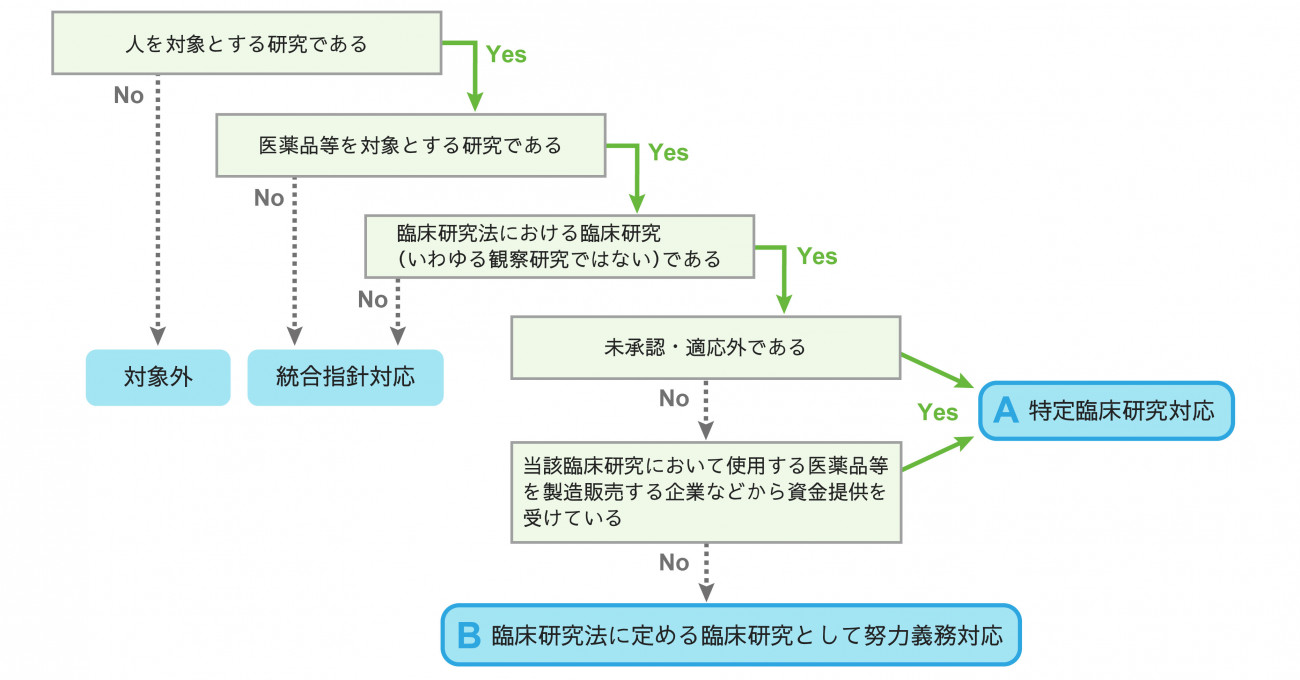
・承認申請を目的としたものは治験として実施します。
・「研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、患者のために最も適切な医療を提供した結果としての診療情報又は資料を利用する研究」を臨床研究法では「いわゆる観察研究」と位置付けています。
※観察研究であっても、医薬品等の有効性又は安全性を明らかにする目的で研究を実施する場合は、臨床研究法の規制対象となる場合がありますので、都度ご相談願います。
・体外診断薬、福祉機器を使用する研究は該当しません。機能性表示食品、トクホ等の食品を使用する研究については、その使用の目的や態様によって「医薬品」とみなされる場合がありますので、都度ご相談願います。
・医薬品等の有効性又は安全性を明らかにする目的で、医薬品等を人に対して投与又は使用すること(医行為に該当するもの)により行う研究を指します。
・手術・手技の臨床研究は原則該当しませんが、実質的に手術・手技で使用する医薬品等を評価することとなる研究については、臨床研究法の対象となる場合があります。
・医薬品等には、被験薬だけでなく、対照薬も該当します。したがって、被験薬が適応内使用で、製薬企業等からの資金提供を受けていない場合であっても、対照薬について適応外使用であったり、資金提供を受けている場合は、特定臨床研究に該当する可能性があります。
・臨床研究法では、侵襲性の程度について触れていないため、上記の定義に該当すれば、侵襲の程度が軽微な場合でも臨床研究法の適用対象となります。
・臨床研究法における適応外の判断は、薬機法上の承認内かどうかに基づいて判断されます。用法等を適応外で使用した場合にも保険が下りるケースがありますが、あくまで薬機法上の承認内かどうかで判断されますので、保険が下りるものは適用内であるということではありません。
・企業から直接資金提供を受けている場合だけでなく、企業が民間財団等に資金提供を行い、当該財団を通して資金提供を受けるような場合も含まれます。なお、現在の法律では、資金提供のみが規制対象とされており、物品や役務の提供は対象とされていません。(今後対象となる可能性があります。)
・製薬企業等が民間財団等に寄付等をし、当該寄付等により実施する公募事業から資金提供を受けている場合、一定の条件(広く公募されている、資金提供元が公表されている等)を満たせば、臨床研究法の規制対象から除外されます。
・特定臨床研究については、実施計画(治験でいう治験届のようなものです)を作成し、認定臨床研究審査委員会において審査を受けなければならない等、さまざまな法対応が必要となります。 法律に違反した場合は、罰則が科される可能性がありますので、ご注意ください。
・臨床研究法と人を対象とする生命科学・医学系研究に関する倫理指針は、別の規制ルールであり、努力義務については、人を対象とする生命科学・医学系研究に関する倫理指針によって研究を実施すれば、臨床研究法を遵守しなくてよいというものではありません。
臨床研究法に定める臨床研究を臨床研究法に従って実施しない場合は、罰則は適用されませんが、法令違反の状態となりますので、これらについても臨床研究法に則って研究を実施するよう努めてください。
当院では、臨床研究法施行後(2018年4月以降)に開始した努力義務対応が必要な研究については、努力義務を遵守し、認定臨床研究審査委員会で審査を受ける等、臨床研究法に則って研究を行っていただくこととしています。
また、数年後には特定臨床研究と同様、義務として法律が改正される可能性があります。
| 区分 | 診療行為/臨床研究(臨床研究の場合は、併せて、倫理委員会等に申請する必要がある。) |
| 委員会名称 | 高難度新規医療技術評価委員会 未承認新規医薬品等評価委員会 |
| 審査対象 | 高難度新規医療技術※1、未承認新規医療品等及び適応外・禁忌による医療※2 ※1本院で実施したことのない医療技術(軽微な術式の変更を除く)であって、その実施により患者の死亡その他重大な影響が想定されるもの(外保連試案の技術区分Eなど) ※2臨床研究法に定める特定臨床研究(医薬品等の未承認適応外使用を行うもの)については、認定臨床研究審査委員会で審査を受けるため、未承認新規医薬品等評価委員会での審査は必要ありません。 |
| 関係法令及び告示 | 医療法施行規則 |
| 担当・申請窓口 | 新規医療技術等管理センター e-mail:shinki-center*adm.niigata-u.ac.jp(*を@に変更してください) |
| 申請方法 | 申請書を提出(下記リンク先の新規医療技術等管理センター関係から洋式をダウンロードして、メール又は院内便で提出) 院内教職員専用HP:https://www3.nuh.niigata-u.ac.jp/ ※学内LANであれば、教室等からもアクセス可能です。 |
| 区分 | 診療行為/臨床研究 |
| 委員会名称 | 特定認定再生医療等委員会 |
| 審査対象 | 第1種・第2種・第3種すべての再生医療等提供計画 ※ただし、本学にて実施される再生医療等提供計画に限ります。 |
| 関係法令及び告示 | 再生医療等安全性確保法 |
| 担当・申請窓口 | 病院基礎・臨床研究支援課臨床研究係 再生医療等担当 e-mail:saiseiiryo*adm.niigata-u.ac.jp(*を@に変更してください) |
| 申請方法 | 申請書を提出(事前に担当へご連絡願います。) |
| 区分 | 臨床研究 |
| 委員会名称 | 中央臨床研究審査委員会 |
| 審査対象 | 臨床研究法に定める特定臨床研究 ・未承認・適応外の医薬品等を使用する研究 ・臨床研究で使用する医薬品等の製造販売企業から研究資金の提供を受けて行う研究 |
| 関係法令及び告示 | 臨床研究法 臨床研究法施行規則 |
| 担当・申請窓口 | 中央臨床研究審査委員会事務局 e-mail:crbcr*adm.niigata-u.ac.jp(*を@に変更してください) |
| 申請方法 | Webページの申請フォームより申請 https://www.crbcr.niigata-u.ac.jp/ |
| 区分 | 臨床研究 |
| 委員会名称 | 治験審査委員会 |
| 審査対象 | ・企業依頼治験(ブリッジ試験及びFIH=first in human 試験を含む。) ・医師主導治験 ・製造販売後臨床試験 ・製造販売後調査 |
| 関係法令及び告示 | ・医薬品医療機器等法 ・医薬品GCP省令 ・医療機器GCP省令 ・再生医療等製品GCP省令 |
| 担当・申請窓口 | 病院治験審査事務局 |
| 申請方法 | 申請書を提出(事前に担当へご連絡願います。) |
| 区分 | 臨床研究 |
| 委員会名称 | 人を対象とする研究等倫理審査委員会 |
審査対象 |
・人(試料・情報を含む。)を対象とした医学系研究(疫学研究及び研究目的で実施する医療行為を含む。) ・医薬品以外の食品あるいは運動等による介入研究 ・適応内の医薬品・医療機器(医療材料を含む。)の使用及び手術・手技に係る症例報告 ※未承認・適応外の医薬品・医療機器(医療材料を含む。)を使用する介入研究・臨床研究に使用する医薬品等と製造販売する企業等から研究資金の提供を受けて実施する研究(臨床研究法に定める特定臨床研究)については、中央臨床研究審査委員会担当までご相談ください。 |
| 関係法令及び告示 | 人を対象とする生命科学・医学系研究に関する倫理指針 |
| 担当・申請窓口 | 研究推進課・倫理審査事務局(病院 基礎・臨床研究支援課内) e-mail:ethics*adm.niigata-u.ac.jp(*を@に変更してください) TEL:025-227-2625 |
| 申請方法 | 電子申請システム(学内専用:https://niigata.bvits.com/rinri/) |
| 区分 | 臨床研究 |
| 委員会名称 | 遺伝子倫理審査委員会 |
| 審査対象 | ヒト由来の細胞(生殖系列細胞,体細胞,がん細胞を含む)に存在するゲノム、遺伝子、mRNA等の配列、構造、発現、又は機能を、試料・情報を用いて解析(試料・情報の提供又は収集・分譲を含む)する研究 |
| 関係法令及び告示 | 人を対象とする生命科学・医学系研究に関する倫理指針 |
| 担当・申請窓口 | 研究推進課・倫理審査事務局(病院 基礎・臨床研究支援課内) e-mail:ethics*adm.niigata-u.ac.jp(*を@に変更してください) 内線:2625 |
| 申請方法 | 電子申請システム(学内専用:https://niigata.bvits.com/rinri/) |
| 区分 | 臨床研究 |
| 委員会名称 | 遺伝子治験臨床研究に関する倫理委員会 |
| 審査対象 | 疾病の治療又は治療法の開発を目的として遺伝子ベクター等を直接人の体内に投与する研究等 |
| 関係法令及び告示 | 遺伝子治療等臨床研究に関する指針 |
| 担当・申請窓口 | 病院基礎・臨床研究支援課臨床研究係 遺伝子治療臨床研究等担当 TEL:025-227-0710 |
| 申請方法 | 申請書を提出(事前に担当へご連絡願います。) |