終了報告書の提出
■ 臨床研究法における研究の終了
臨床研究法では、研究の終了時期が明確にされており、総括報告書及びその概要の提出が研究の終了とされています。
従来の指針では、研究期間の終了時期が明確にされておらず、プロトコールに研究期間も統計解析含まず、症例収集・観察期間のみを記載していた方もいらっしゃると思います。
臨床研究法では、統計解析期間もすべて含めて、最終的に総括報告書の概要を厚生労働大臣に提出するまでが研究期間であり、その間も定期報告等は必要となります。
総括報告書の作成期限
臨床研究に関する内容として研究計画書に記載したすべての評価項目に係るデータの収集を行うための期間が終了した時から原則1年以内
総括報告書の内容
総括報告書には、少なくとも以下の項目が含まれている必要があるとされています。
①臨床研究の対象者の背景情報(年齢,性別等)
②臨床研究のデザインに応じた進行状況に関する情報(対象者数の推移等)
③疾病等の発生状況のまとめ
④主要評価項目及び副次評価項目のデータ解析及び結果
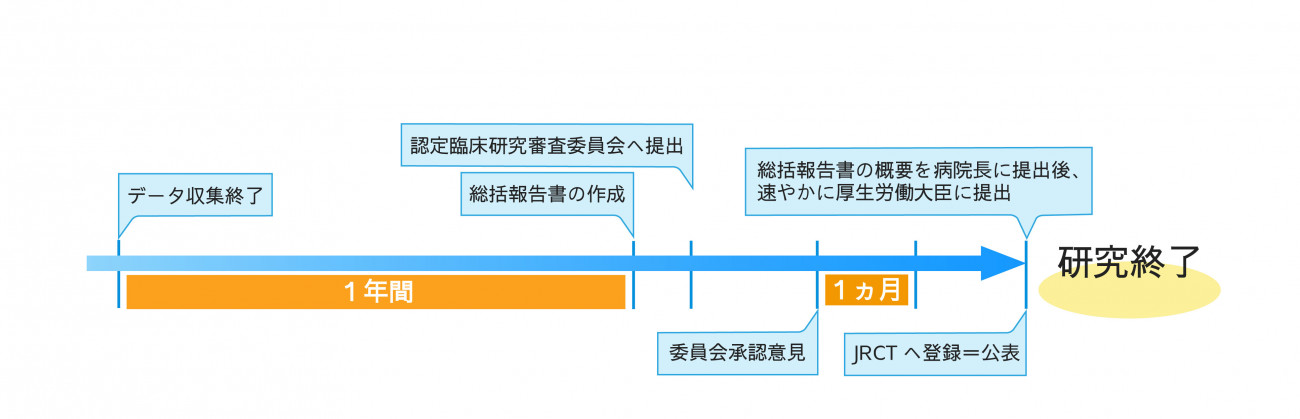
総括報告書の提出の流れ
総括報告書には、少なくとも以下の項目が含まれている必要があるとされています。
①総括報告書の作成
②認定臨床研究審査委員会に総括報告書を提出し、意見を聴く
③認定臨床研究審査委員会が意見を述べた日から1か月以内にjRCTで総括報告書の概要を公表
④病院長へ総括報告書の概要を提出
⑤病院長に提出後、速やかに総括報告書の概要等に研究計画書等を添えて厚生労働大臣に提出
手続きの詳細については、
新潟大学中央臨床研究審査委員会ホームページをご参照ください。
終了通知書の提出
■ 認定臨床研究審査委員会への提出資料
総括報告書以外にも終了通知書や終了届書を実施計画書とあわせて認定臨床研究審査委員会に提出する必要があります。
