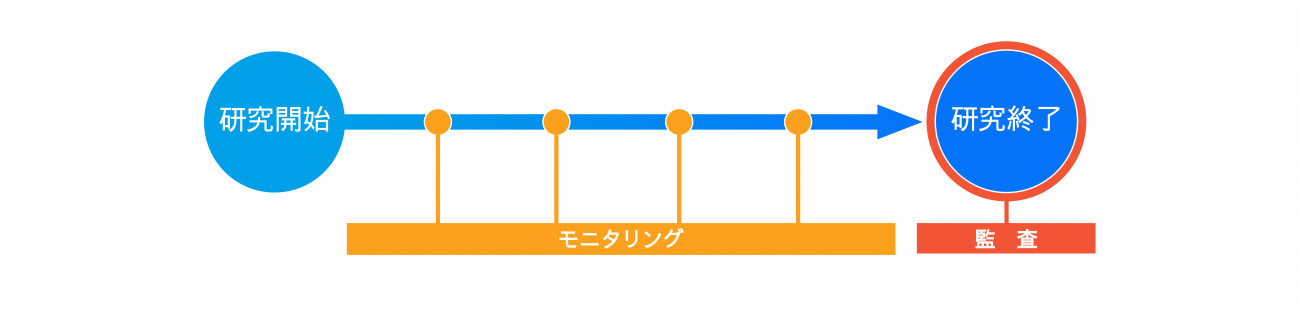
研究実施中の各種報告等
■ 進捗状況の変更
臨床研究法では、作成する実施計画の中に、「特定臨床研究の実施状況」という項目があり、特定臨床研究の実施状況に応じて、当該欄の変更を行う必要があります。
この変更は、変更申請手続きにより行う必要があります。従来の臨床研究においては、変更申請というと研究計画書や同意説明文書の改訂などが想定されますが、臨床研究法においては、これら進捗状況の変更についても変更申請が必要となりますので、ご注意ください。
なお、認定臨床研究審査委員会(CRB)での審査が必要です。簡便審査となる場合があります。
進捗状況の変更が必要な場合
①実施計画「特定臨床研究の進捗状況」の「進捗状況」の変更
募集前(Pending):どの実施医療機関でもまだ募集をしていない
募集中(Recruiting):現在臨床研究の対象者を募集している
募集中断(Suspended):募集が一時的に中断されている
募集終了(Not recruiting):臨床研究は実施中であるが募集が終了している
研究終了(Complete)
②実施計画「特定臨床研究の進捗状況」の「主たる評価項目に係る研究結果」の変更
臨床研究法では、主たる評価項目に係るデータの収集を行うための期間が終了してから1年以内に主要評価項目書の作成(=実施計画の「主たる評価項目に係る研究結果」への記入)が必要とされています。この欄への記載についても、進捗状況の変更として変更申請が必要となります。
③実施計画「第1症例登録日」の記入
実施計画には第1症例登録日を記入する欄があり、新規申請時は空欄で提出します。第1症例登録後、遅滞なく当該欄に記載を行うことが必要であり、この記載は変更手続きによって行います。
■ 定期報告
特定臨床研究においては、研究責任(代表)医師は、1年に1度特定臨床研究の実施状況を認定臨床研究審査委員会(CRB)に報告しなければなりません。また、同様に厚生労働大臣にも報告の義務があります。
特定臨床研究実施者は、厚生労働省令で定めるところにより、定期的に、特定臨床研究の実施状況について、当該特定臨床研究の実施計画に記載されている認定臨床研究審査委員会に報告しなければならない。(臨床研究法第17条)
特定臨床研究実施者は、厚生労働省令で定めるところにより、定期的に、特定臨床研究の実施状況について、厚生労働大臣に報告しなければならない。(同18条)
報告時期
認定臨床研究審査委員会への報告
実施計画を厚生労働大臣に提出した日から起算して、1年ごとに、当該期間満了後2か月以内
厚生労働大臣への報告
定期報告に係る認定臨床研究審査委員会の意見を聴いた日から1か月以内
手続きの詳細については、
新潟大学中央臨床研究審査委員会ホームページをご参照ください。
■ 疾病等報告
臨床研究法では、特定臨床研究の実施に起因するものと疑われる疾病、障害若しくは死亡又は感染症(疾病等といいます)の発生を知ったときは、病院長に報告の上、認定臨床研究審査委員会に報告をしなければならないとされています。 認定臨床研究審査委員会への報告については、疾病等の種類・程度等により報告期限が定められており、そのうち一部のものは厚生労働省に対しても報告の義務があります。
詳細および手続きについては、
新潟大学中央臨床研究審査委員会ホームページをご参照ください。
■ 不適合の報告
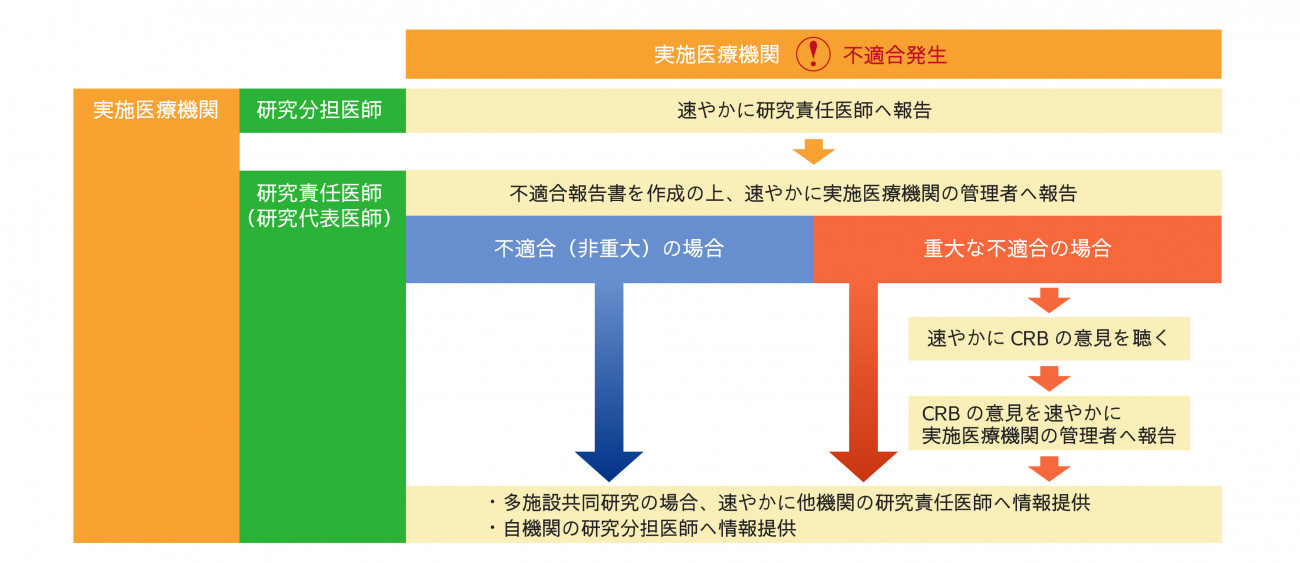
臨床研究法では、臨床研究が省令または研究計画書に適合していない状態(不適合)であると知ったとき、研究責任(代表)医師は、以下の対応をしなければならないとされています。
- 重大なものが判明した場合、速やかに認定臨床研究審査委員会の意見を聴かなければならない
- 多施設共同研究の場合、速やかに他の研究責任医師に情報提供しなければならない
発生した不適合の重大性に応じて、所定の様式にて報告書を作成の上、適切な報告先へ速やかに提出してください。
(*を@に変更してください)
不適合(非重大) |
院内様式:不適合報告書
報告先
病院長:基礎・臨床研究支援課
(r-kenkyu*adm.niigata-u.ac.jp)
|
|
|
重大な不適合 |
統一書式7:重大な不適合報告書
報告先
病院長:基礎・臨床研究支援課
(r-kenkyu*adm.niigata-u.ac.jp)
+
CRB事務局
(crbcr*adm.niigata-u.ac.jp) |
|
不適合とは
不適合:規則、研究計画書、手順書等の不遵守及び研究データの改ざん、ねつ造等
重大な不適合:臨床研究の対象者の人権や安全性及び研究の進捗や結果の信頼性に影響を及ぼすもの
例)選択・除外基準や中止基準、併用禁止療法等の不遵守 (臨床研究の対象者の緊急の危険を回避するためその他医療上やむを得ない理由により研究計画書に従わなかったものについては含まない) |
不適合発生時の報告フロー(例:自機関主幹の研究・自機関にて発生)
以下のフローに準じて、ご報告ください。研究の実施体制及び発生施設別の例:①~④も適宜ご参照ください。
※当院以外では手続きが異なる場合があります。
 ①不適合報告フロー 当院代表・当院で不適合発生
②不適合報告フロー 当院代表・他院で不適合発生
③不適合報告フロー 当院分担・当院で不適合発生
④不適合報告フロー 当院分担・他院で不適合発生
①不適合報告フロー 当院代表・当院で不適合発生
②不適合報告フロー 当院代表・他院で不適合発生
③不適合報告フロー 当院分担・当院で不適合発生
④不適合報告フロー 当院分担・他院で不適合発生
不適合報告フロー図
研究の実施体制及び発生施設別の例:①~④を図の形式にしたものです。あわせてご参照ください。
※当院以外では手続きが異なる場合があります。
①不適合報告フロー図 当院代表・当院で不適合発生
②不適合報告フロー図 当院代表・他院で不適合発生
③不適合報告フロー図 当院分担・当院で不適合発生
④不適合報告フロー図 当院分担・他院で不適合発生
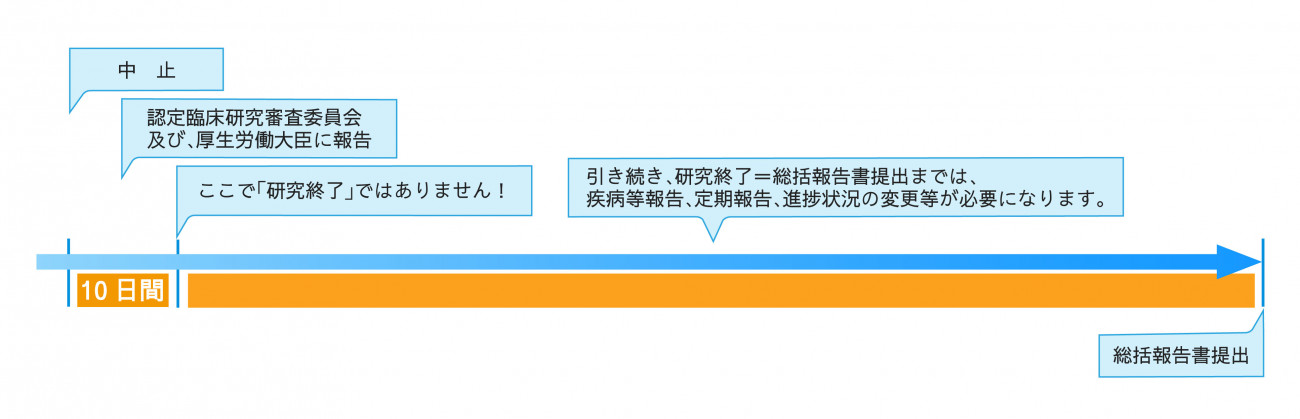
■ 中止報告
臨床研究法においては、特定臨床研究を中止した時は、その中止の日から10日以内に、その旨を認定臨床研究審査委員会に通知するとともに、厚生労働大臣に届け出なければならない、とされています。
特定臨床研究を中止する場合は、研究対象者に適切な措置を講じてください。
また、中止届を提出した場合においても、終了の手続き(=総括報告書の作成)は必要になります。総括報告書の提出が研究終了となりますので、それまでの期間においては、研究が継続している扱いになります。引き続き、疾病等報告や定期報告、進捗状況の変更があれば変更申請が必要になりますので、ご注意ください。
手続きの詳細については、
新潟大学中央臨床研究審査委員会ホームページをご参照ください。