■ モニタリング
医師主導治験が治験実施計画書及び適用される規制要件に従って実施されていることを確認するための品質管理活動です。
研究が適切に実施されていることを治験期間を通して確認し、必要に応じて是正措置を講じるものです。
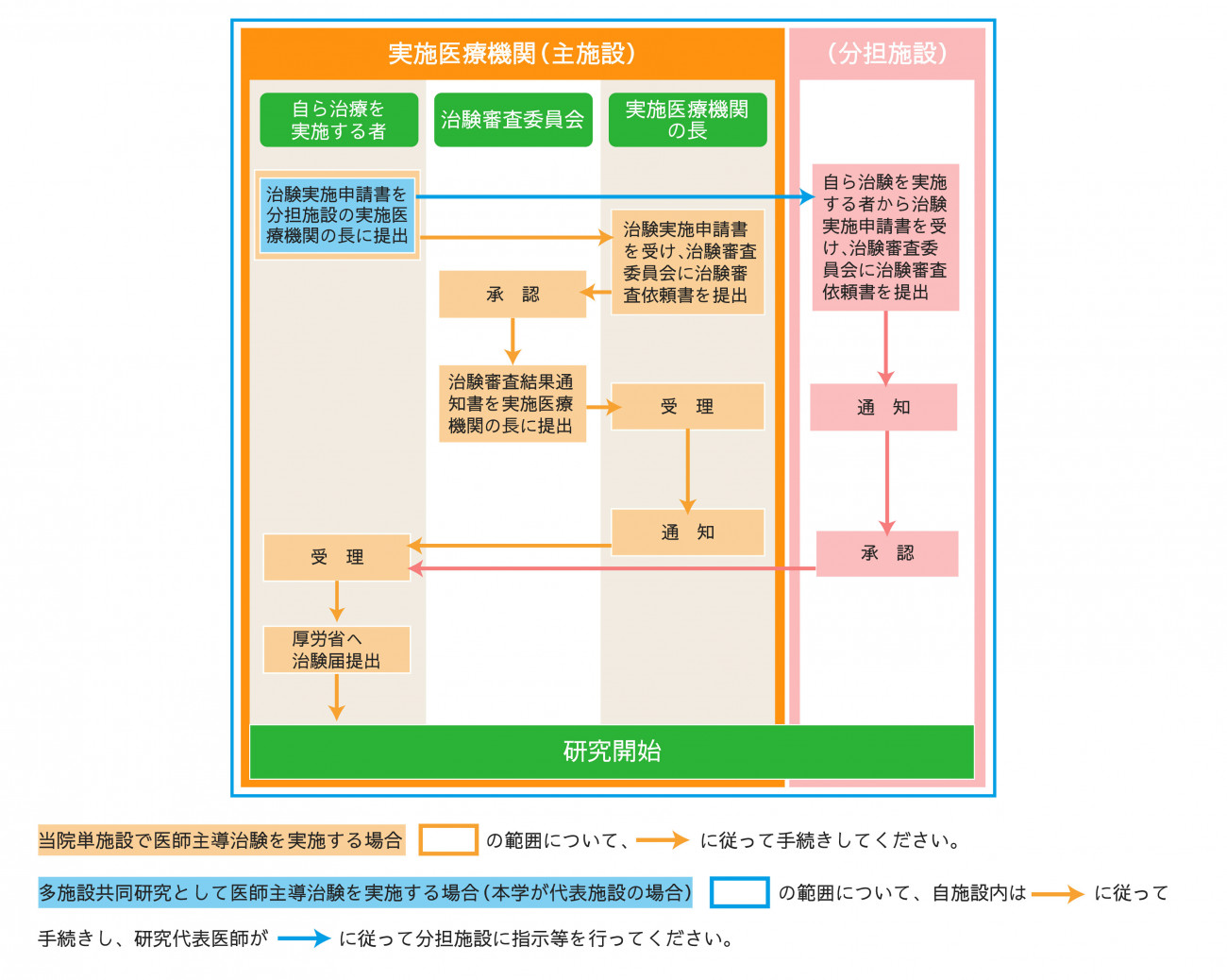
GCP省令では、医師主導治験を実施する場合は、モニタリングに関する手順書を作成し、手順書と研究計画書に定めるところにより、モニタリングを実施することを義務付けています。また、自ら治験を実施する者は、その手順書を各実施医療機関の長に提出して承認を得るとともに、IRBの承認も得る必要があります。
- 研究責任医師は、モニタリングに従事する者が行うモニタリングに関し、自施設においてモニタリングの実施が計画のとおりに適切に履行されていることを確認する必要があります。
- モニタリングの対象となる治験に従事する者がモニタリングをすることはできません。なお、外部委託することも可能です。
※臨床研究推進センターでは、モニタリング計画書の作成支援、チェックリストの作成等、院内でモニタリングを実施するための各種支援を行っています。 お気軽に
お問い合わせよりご相談ください。
■ 監査
医師主導治験が治験実施計画書及び適用される規制要件に従って実施されていたかを評価するための品質保証活動です。
GCP省令では、医師主導治験を実施する場合は、監査に関する計画書および業務に関する手順書を作成し、治験審査委員会の意見を踏まえて、当該計画書及び手順書に従って監査を実施させなければならない、とされています。